
El 21 de noviembre, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) publicó 13 memorandos sobre las políticas científicas para revisar las solicitudes de pre-mercado de cigarrillos electrónicos, abarcando desde 2020 hasta 2023. La FDA afirmó que estos memorandos describen los procesos y métodos prioritarios utilizados para presentar y revisar los cigarrillos electrónicos con sabor y otras solicitudes PMTA. (Para más detalles, ver: la FDA de EE. UU. publica 13 memorandos de políticas científicas regulatorias centradas en métodos de revisión de cigarrillos electrónicos con sabor)

A la luz del memorándum publicado, 2Firsts realizó investigaciones y consultó con varios expertos en cumplimiento normativo y descubrió que se ha enfatizado la importancia de la "tecnología de verificación de edad", lo que significa que los dispositivos con verificación de edad recibirán revisiones prioritarias. Además, algunos memorandos también revelaron los requisitos adicionales de la FDA para estudios de sabor en revisiones posteriores.

Memorando | Fuente de la imagen: FDA Priorización de presentaciones para PMTAs recibidas entre el 10 de septiembre de 2020 y el 3 de noviembre de 2021

Los productos con verificación de edad recibirán una revisión prioritaria.

Un memorando titulado "Priorización de presentación de solicitudes de autorización para productos de tabaco previo al mercado (PMTA) recibidas entre el 10 de septiembre de 2020 y el 3 de noviembre de 2021" proporciona un resumen detallado de la política y antecedentes de la FDA sobre la priorización de las solicitudes de autorización para productos de tabaco previo al mercado (PMTA) recibidas.
En el memorándum, la FDA explicó los principios fundamentales de sus prioridades de revisión, que principalmente incluyen los siguientes dos aspectos:
Fecha de Presentación de Base: Las solicitudes suelen ser revisadas en el orden de la fecha de presentación para las PMTA. Por ejemplo, los productos presentados el 10 de septiembre tendrán prioridad sobre los productos presentados el 15 de septiembre. Priorización Especial: Algunas solicitudes con tecnología especial o importancia para la salud pública pueden recibir prioridad. Por ejemplo, un memorándum mencionó específicamente a una empresa que presentó una PMTA con "tecnología de verificación de edad" que estaría siendo priorizada debido a su potencial impacto en la salud pública. La FDA declaró: "La solicitud fue priorizada para su presentación porque contiene presunta tecnología de verificación de edad.
El memorando revela un hecho que los productos con 'Age gating' pueden acelerar el proceso de revisión al avanzar directamente a la tercera etapa de revisión después de pasar la segunda ronda de auditoría," afirmó el consultor experto en cumplimiento Kurt de 2Firsts.

Kurt dijo: "Mi comprensión es que la FDA priorizará los productos con verificación de edad para su revisión, permitiéndoles saltar directamente a la tercera etapa del proceso de aprobación, pero los estándares de revisión no han sido reducidos".
También cree que esto demuestra la lógica de la FDA al revisar los cigarrillos electrónicos: los dispositivos con capacidades de verificación de edad pueden prevenir eficazmente el uso adolescente, por lo que se consideran una prioridad.
Él afirmó que estos tipos de productos pueden no necesitar ensayos controlados aleatorizados (RCT) costosos o estudios de cohorte a largo plazo porque sus dispositivos finales ya han desempeñado un papel en la prevención y control del abuso adolescente.
Los productos de sabor deben demostrar "beneficios incrementales".
En otro memorando titulado "DISPOSITIVOS DE NICOTINA ELECTRÓNICOS (ENDS) Conteniendo Líquido con Sabores que no son de Tabaco: Enfoque a las PMTAs no en Revisión Científica Sustantiva (Fase III)", la FDA discutió la estrategia de gestión de solicitudes de productos de tabaco pre-mercado (PMTA) para los cigarrillos electrónicos con sabores que no son de tabaco (ENDS).
La FDA, en un memorando, explicó sus estándares de revisión, citando la sección 910 de la Ley de Alimentos, Medicamentos y Cosméticos de los Estados Unidos, que establece que la clave de la revisión es si un producto es adecuado para "proteger la salud pública". Los cigarrillos electrónicos con sabores que no son de tabaco necesitan demostrar que ofrecen un "beneficio incremental" a fumadores adultos en comparación con los productos con sabor a tabaco.
El concepto de "beneficio incremental" se puede entender como la FDA exigiendo al remitente de un cigarrillo electrónico con sabor no tabaquero demostrar que brinda beneficios adicionales a los fumadores adultos en comparación con los productos con sabor a tabaco u otras opciones existentes. Esta evaluación requiere evidencia de ensayos controlados aleatorizados (RCT) o estudios de cohorte longitudinal.
La falta de proporcionar la investigación mencionada anteriormente puede considerarse un "defecto fatal", lo que podría resultar en la emisión de una Orden de Denegación de Marketing (MDO).
Kurt declaró que a partir de julio de 2021, la FDA agregó un requisito de pruebas clínicas a largo plazo de los sabores al proceso de revisión. Este requisito adicional resultó en que numerosas empresas fueran consideradas no calificadas, con miles de órdenes de rechazo del mercado emitidas a los negocios. Como resultado, estas empresas han presentado múltiples demandas contra la FDA, alegando que este requisito adicional contradice los estándares originales de revisión del PMTA.
¿Cómo define la FDA los "sabores no derivados del tabaco"?
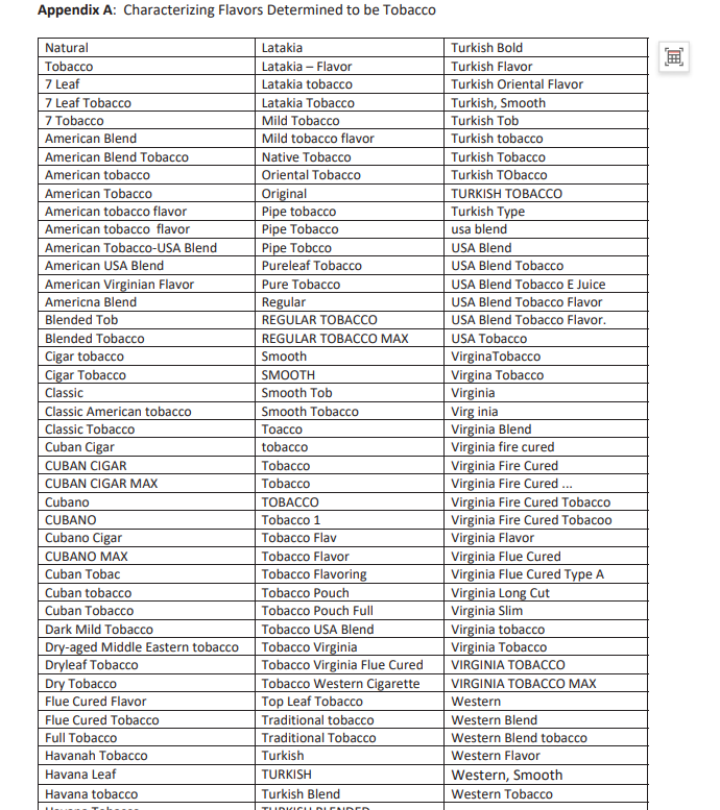
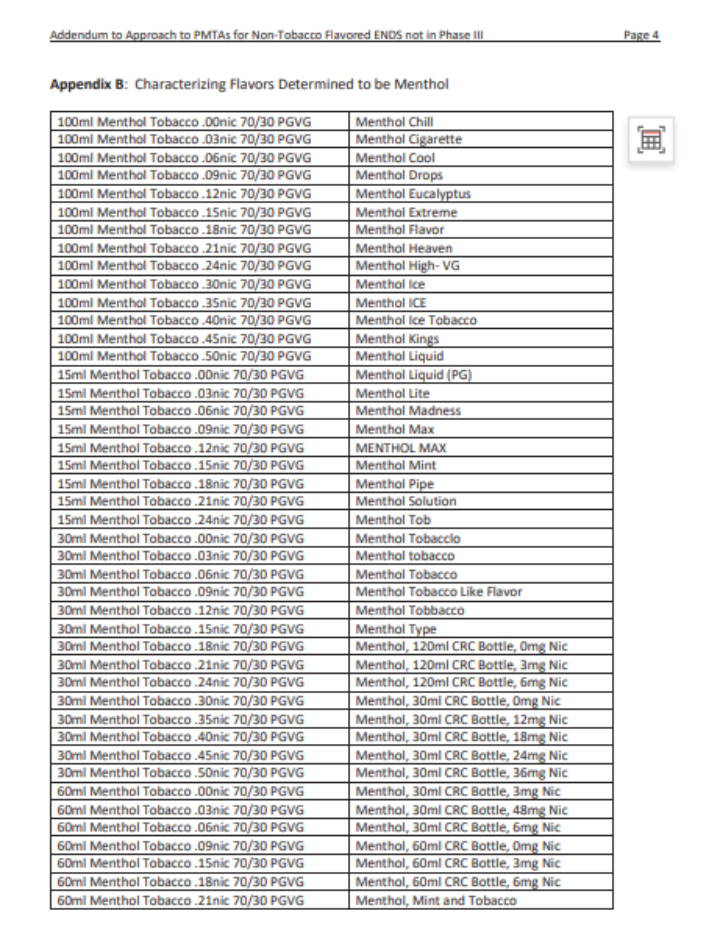
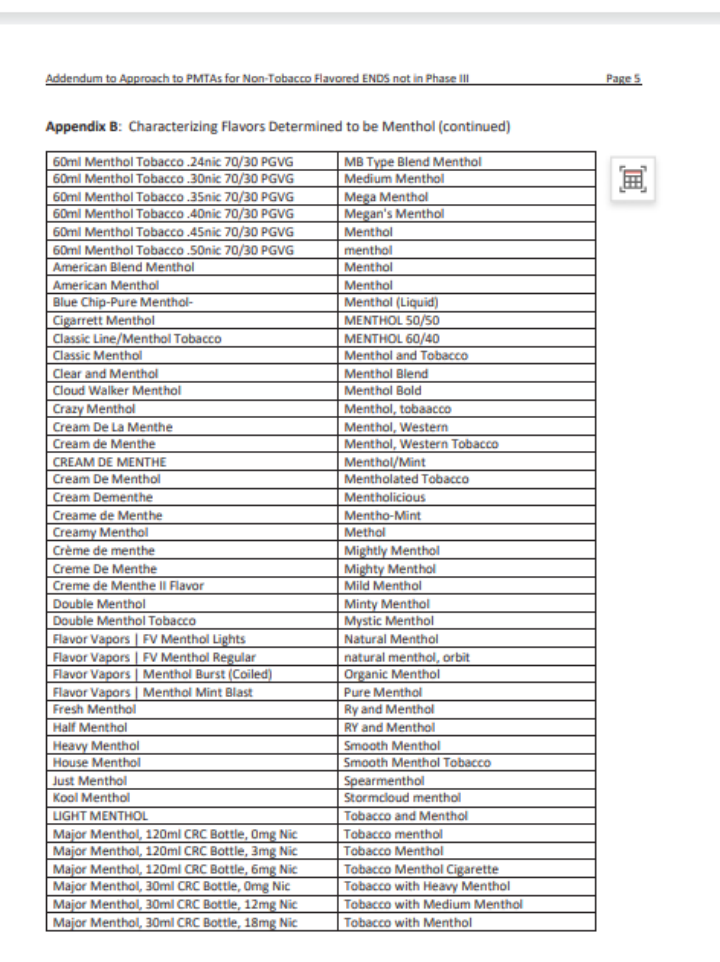
Un memorándum titulado "Anexo al Enfoque de PMTAs para ENDS con sabores no tabacaleros no en Revisión Científica Substancial (Fase III)" proporciona aclaraciones sobre qué productos se incluyen en los sabores no tabacaleros, y define el alcance de los sabores "tabaco" y "menta". La FDA ha delineado esto en el memorándum para identificar claramente qué productos se consideran ENDS con sabores no tabacaleros.
Kurt afirmó que los sabores de tabaco y menta en estas dos listas no estarán sujetos a revisión de productos saborizantes. Solo los SKU DE SABOR pasarán por revisiones clínicas a largo plazo en busca de posibles fallos graves, y si no hay evidencia relevante, la FDA les enviará una carta MDO.
Esta es la cuarta serie de memorandos publicada en 2024, la FDA ha publicado un total de 26 memorandos de política de ciencia regulatoria. Aunque la FDA afirma que estos memorandos no pueden ser usados como guía para futuras solicitudes, el análisis e interpretación de estos memorandos aún contribuye a una comprensión más profunda y precisa de los conceptos y enfoques de revisión de la FDA para los cigarrillos electrónicos.
Dos generales supremos continuarán monitoreando los últimos desarrollos en la regulación de los cigarrillos electrónicos en los Estados Unidos.
Con respecto a este artículo, si tienes alguna opinión adicional, información relevante o perspectivas de la industria, no dudes en ponerte en contacto con nosotros por correo electrónico a: info@2firsts.com.
Aviso
1.Este artículo se proporciona exclusivamente para fines de investigación profesional relacionados con la industria, la tecnología y la política. Cualquier referencia a marcas o productos se realiza únicamente con fines descriptivos y no constituye un respaldo, recomendación o promoción de ninguna marca o producto.
2.El uso de productos de nicotina, incluidos pero no limitados a cigarrillos, cigarrillos electrónicos y productos de tabaco calentado, está asociado con riesgos significativos para la salud. Se requiere que los usuarios cumplan con todas las leyes y regulaciones pertinentes en sus respectivas jurisdicciones.
3.El acceso o la visualización de este artículo está estrictamente prohibido para personas que no hayan alcanzado la edad legal.
Aviso de Derechos de Autor
Este artículo es una obra original de 2Firsts o una reproducción de fuentes de terceros con la fuente original claramente indicada. Los derechos de autor y los derechos de uso de este artículo pertenecen a 2Firsts o a la fuente original. La reproducción, distribución o cualquier otro uso no autorizado de este artículo por cualquier entidad o individuo está estrictamente prohibido. Los infractores serán legalmente responsables. Para asuntos relacionados con los derechos de autor, por favor contacte a: info@2firsts.com
Descargo de Responsabilidad por Asistencia de IA
Este artículo puede haber utilizado IA para mejorar la eficiencia en la traducción y edición. Sin embargo, debido a limitaciones técnicas, pueden ocurrir errores. Se recomienda a los lectores que consulten las fuentes proporcionadas para obtener información más precisa.
Este artículo no debe utilizarse como base para decisiones o consejos de inversión, y 2Firsts no asume ninguna responsabilidad directa o indirecta por cualquier error en el contenido.



